Nach der Lektüre dieses DFP-Literaturstudiums wissen Sie über die prognostische Bedeutung von Infektionen mit dem Cytomegalievirus (CMV) nach allogener Transplantation hämatopoetischer Stammzellen (allo-HSZT) Bescheid, kennen Risikofaktoren für das Auftreten von CMV-Infektionen und -Erkrankungen sowie wichtige diagnostische, prophylaktische und therapeutische Maßnahmen.
Primäre Zielgruppe: Ärztinnen und Ärzte für Allgemeinmedizin/Innere Medizin, die mit der Betreuung von allo-HSZT-Patienten befasst sind.
Transplantation hämatopoetischer Stammzellen & Cytomegalievirus – Therapie und Prophylaxe
Die Seroprävalenz des Zytomegalievirus (CMV) schwankt stark (40–100%) in Abhängigkeit von geografischer Region, sozioökonomischen Faktoren, Alter sowie medizinischen Eingriffen wie einer Organtransplantation. Die Prävalenz dieser Herpesviren wird mittels Antikörpertests aus dem Blut repräsentativer Kohorten – wie zum Beispiel Blutspendern – gemessen. In einer deutschen Kohorte wurde eine 56,7%ige Prävalenz von CMV gemessen. [1] Die CMV-Seroprävalenz war bei Frauen (62,3%) höher als bei Männern (51,0%) und nahm mit zunehmendem Alter zu: von 31,8% auf 63,7% bei Männern und von 44,1% auf 77,6% bei Frauen, wenn man die 18- bis 29-Jährigen mit der Altersgruppe der 70- bis 79-Jährigen vergleicht. Bei Frauen im gebärfähigen Alter (18–45 Jahre) betrug die CMV-Seroprävalenz 51,7%. Faktoren, die maßgeblich mit der CMVSeropositivität in Verbindung gebracht wurden, waren Alter, Geburtsland, Raucherstatus, Bildung, Leben in Norddeutschland und die Anzahl der Haushaltsmitglieder. Darüber hinaus war bei Männern der Besuch eines Kindergartens als Kind mit CMV-Seropositivität assoziiert.
Eine bedrohliche Manifestation bei Patienten nach allo-HSZT ist die CMV-assoziierte Retinitis. Dies gilt besonders für pädiatrische Patienten und Patienten, die neben den üblichen Immunsuppressiva weitere Medikamente (z.B. Bortezomib, Rituximab) erhalten. Eine Inzidenz von 23% wird bei pädiatrischen Patienten mit einer hohen CMV-DNA-Konzentration im Blut innerhalb von 199 Tagen nach Transplantation berichtet. [2] Virämien vor der Transplantation, akute Graft-versus-Host-Erkrankung (GvHD) und Spender–/Empfänger+-Konstellationen wurden als unabhängige Risikofaktoren für die Entwicklung von CMV-Retinitiden identifiziert. Daher wird empfohlen, bei diesen Hochrisikopatienten ophthalmologische Kontrolluntersuchungen durchzuführen. Magen-Darm-Erkrankungen sind die häufigste Form der CMV-Erkrankung. Problematisch ist hierbei, dass diese Erkrankungen nicht immer mit einem entsprechenden Nachweis aus Blut einhergehen. Bis zu 25% der betroffenen Patienten, die über die pp65-Antigenämie oder Nukleinsäuretestung (NAT) aus Blut überwacht werden, werden nicht erkannt. [3, 4]
Antivirale Therapie und Prophylaxe
Die grundsätzlich verfügbaren Medikamente zur systemischen Therapie von CMV, Ganciclovir (GCV) und sein orales Prodrug Valganciclovir (VGCV), Foscarnet (FOS) und Cidofovir (CDV), haben die virale DNA-Polymerase als Ansatzpunkt. Das Nukleosidanalogon GCV wird durch die viruscodierte Proteinkinase pUL97 monophosphoryliert [5, 6] und anschließend durch zelluläre Enzyme zu Triphosphat umgewandelt. Das Triphosphat hemmt die virale DNA-Synthese. Der Einbau von GCV in die virale DNA führt nicht zu einem obligatorischen Kettenabbruch, wie es für Aciclovir gezeigt wurde, sondern verursacht eine Abnahme der DNA-Polymerisationsgeschwindigkeit. [7] CDV, ein Cytosin-Analogon, liegt als Phosphonat vor. Die UL97-Funktion ist nicht erforderlich, weil es durch zelluläre Enzyme direkt in das aktive Triphosphat umgewandelt wird. [8] Das Pyrophosphat-Analogon FOS (Phosphonoameisensäure) blockiert die Pyrophosphat-Bindungsstelle der viralen Polymerase. Da CDV und FOS nicht von einer pUL97-vermittelten Phosphorylierung abhängen, können beide gegen CMV-Varianten mit Mutationen im pUL97 eingesetzt werden.
Das 3,4-Dihydroquinazolin Letermovir interagiert mit der viralen UL56-Untereinheit (Terminase), die an der viralen DNAProzessierung und/oder -Verpackung beteiligt ist. [9] Daher zeigt die Verbindung einen komplett anderen Wirkmechanismus als GCV, CDV oder FOS. Die Substanz wurde bei der Behandlung von multiresistenten CMV [10] und in klinischen Phase II/III-Studien zur prophylaktischen Anwendung nach allo-HSZT erfolgreich eingesetzt, [11-13] worauf sie kürzlich von der FDA und EU zugelassen wurde.
Gegen alle antiviralen Substanzen können Resistenzen selektioniert werden, [14] im Extremfall können durch den gleichen Wirkmechanismus auch Kreuzresistenzen verursacht werden – nicht jedoch mit Letermovir, sodass eine Wirksamkeit dieser Substanz selbst bei Resistenz gegenüber allen anderen verfügbaren antiviralen Substanzen zu erwarten ist.
Alle älteren Substanzen sind mit therapielimitierenden Toxizitäten behaftet. Die wichtigste Nebenwirkung von GCV ist eine Myelotoxizität. Zu beobachten sind eine Leukozytopenie, Thrombozytopenie, Anämie oder sogar eine Knochenmark-Hypoplasie. FOS und CDV zeigen eine relevante Nierentoxizität. Für Letermovir sind bisher keine schwerwiegenden Arzneimittelnebenwirkungen bekannt.
GCV und VGCV können bei SOT („solid organ transplantation“) und allo-HSZT präemptiv, d.h. erst bei nachgewiesener Virusreplikation, oder bei SOT prophylaktisch, d.h. bereits mit Beginn der Transplantation, eingesetzt werden. Eine antivirale Prophylaxe mit diesen Substanzen wird bei allo-HSZT nicht empfohlen wegen der häufigen Nebenwirkungen.
Die prophylaktische Gabe von Letermovir hat in der Phase-III-Zulassungsstudie im Vergleich zu Placebo bei sehr geringen Nebenwirkungen die CMV-bedingte Morbidität und Mortalität signifikant reduziert: In Woche 24 lag der Prozentsatz an Patienten mit klinisch signifikanter CMVInfektion unter Letermovir bzw. Placebo bei 37,5% bzw. 60,6%. [12]
Alternativ kann eine prophylaktische Gabe von GCV bzw. VGCV erfolgen. Diese ist allerdings belastet durch das hohe Risiko für therapieinduzierte Neutropenie, die v. a. kurz nach Transplantation in der Phase der hämatologischen Rekonstitution eine erhebliche Problematik darstellt. Eine placebokontrollierte Studie konnte für CMV-seropositive Patienten eine Reduktion der CMV-Infektionen (3 % vs. 45%; p=0,0001) und CMV-Erkrankungen (10 % vs. 29 %; p = 0,0008) unter GCV ab dem Engraftment (5 Tage 2 x 5 mg/kg/d i.v., dann weiter bis d+100 mit 1 x 5 mg/kg/d i.v.) zeigen. [15] Hier wurde die Problematik der GCV-Prophylaxe deutlich, da nach Tag 100 bei 10 % der behandelten Patienten eine CMV-Erkrankung auftrat und sich letztlich insgesamt kein Vorteil bezüglich des Überlebens für die Behandlungsgruppe ergab. Der Effekt der Prophylaxe konnte in einem systematischen Review mit Metaanalyse bestätigt werden. [16•] Wegen der geringeren Toxizität wird in der klinischen Praxis Letermovir im Vergleich zur GCV für die Prophylaxe präferiert.
Die durch GCV verursachte Neutropenie tritt bei 30–60% der behandelten Patienten auf und hat im Median eine Dauer von 12 (4–20) Tagen. [17] Kombinationen von GCV mit hoch dosiertem Aciclovir oder FOS wurden bei pädiatrischen Transplantationen oder solchen mit Nabelschnur-Restblut eingesetzt und zeigten einen positiven Effekt auf CMV-Infektion/-Erkrankung. [18, 19] Eine generelle Empfehlung zur prophylaktischen Gabe von hoch dosiertem Aciclovir oder GCV lässt sich aus den angeführten Studien nicht ableiten. Die Untersuchungen zur prophylaktischen Gabe von Aciclovir zeigen bei intravenöser Gabe in der unmittelbaren Posttransplantationsphase und Fortsetzung mit oralem Valaciclovir einen positiven Effekt auf CMV-Infektionen und eine Reduktion der Patientenzahl mit präemptiver Therapie auf 50%, jedoch keine Verbesserung der Überlebenszeit insgesamt, insbesondere durch die hohe Rate an Nebenwirkungen in Verbindung mit den sehr hohen Dosierungen, die zur Erreichung einer therapeutischen Wirksamkeit erforderlich sind. [20] Bei Patienten nach In-vitro-T-Zell-Depletion konnte die hohe Rate der CMV-Reaktivierungen von 83% durch diese hoch dosierte Aciclovir-Gabe nicht reduziert werden. [21]
Überlegen Sie:
Was können Ursachen für eine erhöhte Mortalität von alloHSZT-Patienten sein?
CMV-Seropositivität, -Infektion, -Reaktivierung, Abstoßungsreaktion, GvHD, Medikamententoxizitäten, andere virale, bakterielle oder fungale Infektionen.
Folgen einer CMV-Infektion bei allo-HSZT-Patienten
Die klinischen Konsequenzen einer CMV-Infektion nach der Transplantation sind beträchtlich und werden in der Regel in Bezug auf direkte und damit verbundene Effekte diskutiert. Die direkten Auswirkungen der CMV-Reaktivierung hängen mit dem Risiko für die Entwicklung einer CMVKrankheit zusammen, während die damit verbundenen Auswirkungen von CMV klinische Ereignisse sind, die sich aus der CMV-Seropositivität oder CMV-Reaktivierung allein ergeben, ohne die Entwicklung einer CMV-Krankheit. CMV-Seropositivität und CMV-Reaktivierung sind mit erheblichen klinischen Belastungen verbunden, wie z. B.:
Lebensbedrohliche Komplikationen einschließlich bakterieller und Pilzinfektionen
Erhöhte Inzidenz akuter Graft-versusHost-Erkrankung (GvHD) Grad
Negative Auswirkungen des Engraftments
Deutlich erhöhtes Risiko für die Gesamtsterblichkeit – auch bei Anwendung einer präventiven Behandlung („preemptive therapy“, PET)
Patienten, bei denen eine CMV-Infektion nach allo-HSZT diagnostiziert wurde, werden mit antiviralen Medikamenten, der sogenannten präemptiven Therapie (PET), behandelt. Obwohl diese antiviralen Medikamente gegen CMV-Infektionen wirksam sind, sind sie mit einer signifikanten Morbidität und Mortalität und einer anschließenden hohen wirtschaftlichen Belastung aufgrund des Krankenhausaufenthalts und der möglichen Behandlung antiviraler Arzneimitteltoxizitäten wie Myelosuppression und Nephrotoxizität [22] verbunden. Es gibt auch eine erhebliche Kreuzresistenz zwischen den antiviralen Medikamenten, die die Verwendung von PET behindern kann. So bleiben CMV-Seropositivität und frühe CMV-Reaktivierung nach allo-HSZT mit erhöhter Mortalität verbunden. [12]
Überlegen Sie:
Welche Faktoren sind relevant bei der Entscheidung für eine prophylaktische CMV-Therapie nach allo-HSZT?
Art der Transplantation, Patientenalter, Komorbiditäten, Nebenwirkungen und Toxizitäten, virale Genetik und Resistenzen, Wirkmechanismus.
Prophylaktische Behandlung – RWE-Daten
Mit zunehmender klinischer Anwendung von Letermovir erhalten immer mehr Patienten Zugang zu dieser prophylaktischen Behandlung von CMV, es werden „Real World Experience“(RWE)-Daten verfügbar und auf internationalen wissenschaftlichen Kongressen vorgestellt. Es werden im Folgenden Daten aus sechs wissenschaftlichen RWE-Studien diskutiert, die den klinischen Wert von Letermovir belegen, einschließlich der Mortalitätsdaten in drei der Studien; vier Studien stammen aus den USA, eine aus Deutschland und eine aus Japan.
RWE USA – MD Anderson Cancer Center
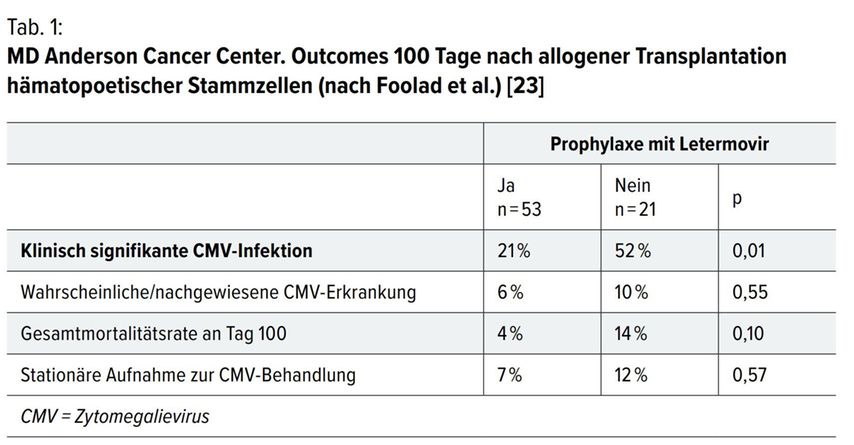
Diese retrospektive, Single-Center-Studie, die im Oktober 2019 veröffentlicht wurde, schloss allo-HSZT-Patienten ein, die zwischen Jänner 2018 und Juni 2018 transplantiert wurden. [23] Der primäre Endpunkt war die Inzidenz einer klinisch signifikanten CMV-Infektion (CMV-Virämie, die eine präventive Behandlung oder CMVKrankheit erfordert). Die primäre Letermovir-Prophylaxe begann im Median 7 Tage (Bereich, 7–40 Tage) nach allo-HSZT.
Die Untersuchung zeigte, dass 39 Patienten eine primäre Prophylaxe mit Letermovir erhielten und die mediane Prophylaxedauer 116 Tage (12–221 Tage) betrug. Bei 29 Patienten (74%) dauerte die primäre Prophylaxe aufgrund einer verzögerten T-Zell-Rekonstituierung über 14 Wochen nach alloHSZT.
Klinisch signifikante CMV-Infektionen traten bei 2 von 39 Patienten (5,1%) auf. Die mediane Nachbeobachtungszeit betrug 117 Tage (Bereich: 12 bis 270 Tage). Am Ende des Follow-ups waren 6 (11,3%) Patienten verstorben. Zu den Todesursachen zählten Rückfälle oder das Fortschreitender Krankheit (N=4) und GvHD (N=2). Die Todesfälle waren nicht direkt auf die CMVInfektion zurückzuführen.
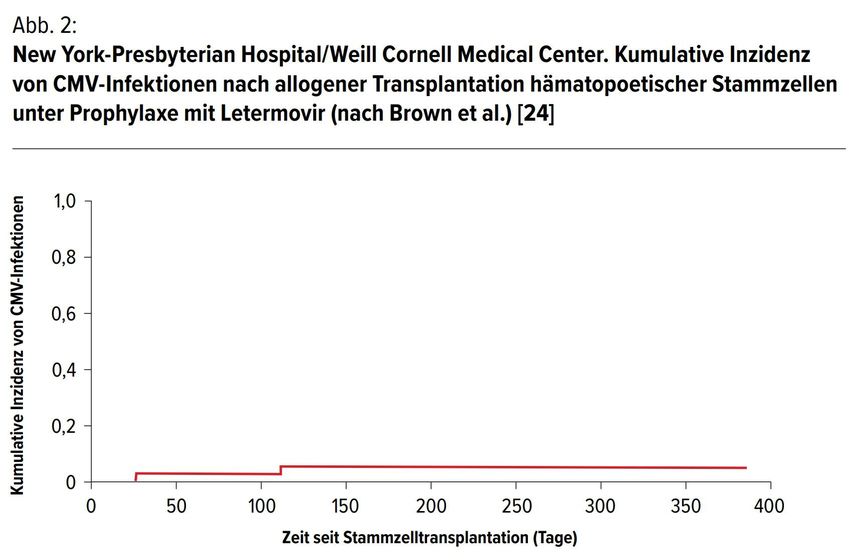
Bei dieser einzelzentrischen, retrospektiven Kohortenstudie erhielten CMV-seropositive allo-HSZT-Patienten mit T-ZellDepletion (TCD) eine Letermovir-Prophylaxe und wurden mindestens 100 Tage nach der Transplantation nachverfolgt. [24] Der primäre Endpunkt war die Inzidenz einer CMV-Infektion (definiert als CMV-Virämie, die eine Behandlung zur Verhinderung einer Endorganerkrankung rechtfertigt). Die historische Rate der CMV-Reaktivierung bei CMV-seropositiven Empfängern an diesem Zentrum war 35% trotz einer hoch dosierten Valacyclovir-Prophylaxe. Die Letermovir-Prophylaxe wurde an diesem Zentrum im Februar 2018 begonnen.
Die mediane Nachbeobachtungszeit erstreckte sich über 196 Tage. Die kumulative Inzidenz einer CMV-Infektion in den ersten 100 Tagen nach der Transplantation betrug 3% (1/36). Innerhalb der ersten 150 Tage nach der Transplantation betrug die kumulative Inzidenz einer CMV-Infektion 6% (2/34).
RWE USA – Memorial Sloan Kettering Cancer Center (MSKCC): periphere Blutstammzellen/Knochenmark
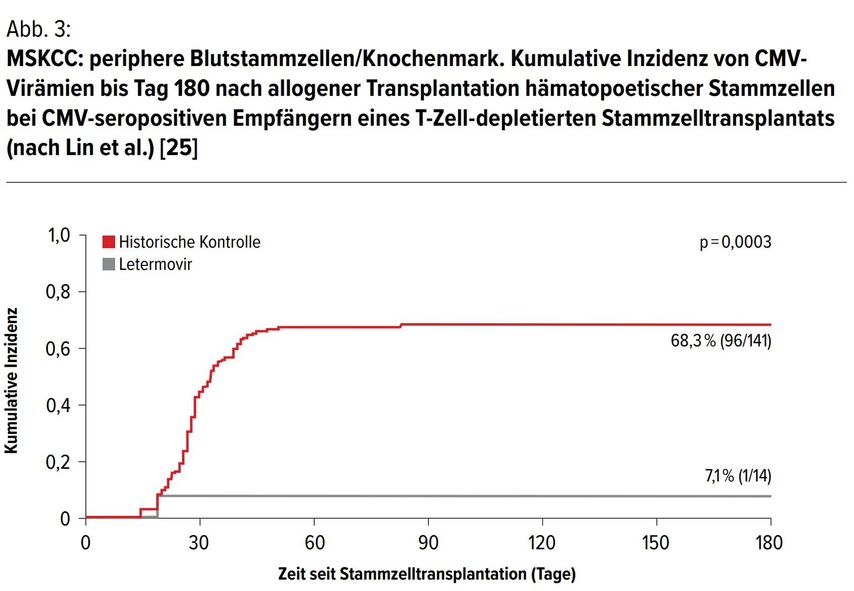
Dies war eine 6-monatige, retrospektive Studie zur Untersuchung von 74 erwachsenen CMV-seropositiven Patienten, die eine allo-HSZT aus peripherem Blut oder Knochenmark erhalten hatten und Tag 100 nach der Transplantation erreichten. [25]
Letermovir wurde bei 53 Patienten (72%) und kein Letermovir bei 21 Patienten (28%) angewendet. Der häufigste Grund für das Nichtverabreichen von Letermovir waren Versicherungen/Kosten (57%). Die Ergebnisse zeigten, dass signifikant mehr Patienten in der Nicht-Letermovir-Gruppe (52%) eine klinisch signifikante CMV-Infektion im Vergleich zur Letermovir-Gruppe erlitten (21%, p=0,01). Eine numerisch höhere Gesamtsterblichkeitsrate bis Tag 100 wurde in der NichtLetermovir-Gruppe beobachtet
RWE USA – Memorial Sloan Kettering Cancer Center (MSKCC): Nabelschnurblut
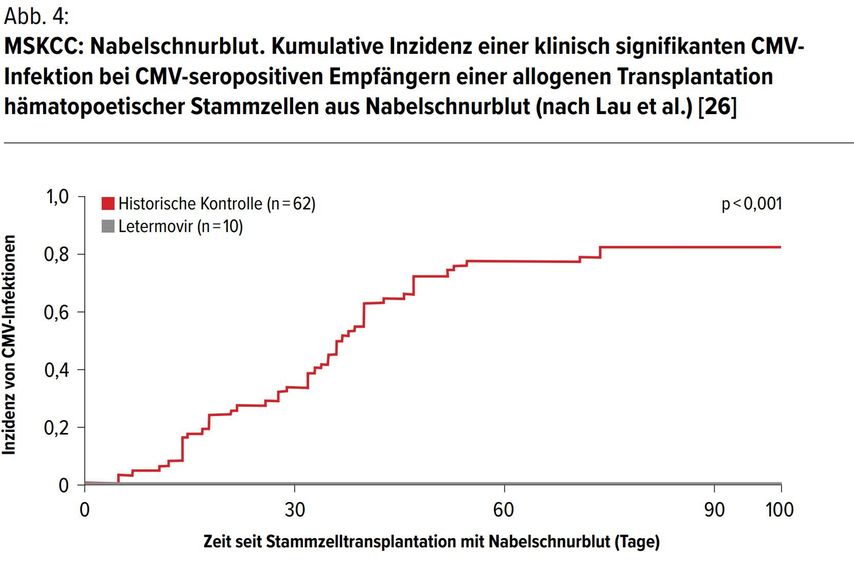
Dies war ein einzelzentrischer, retrospektiver Vergleich von erwachsenen CMV-seropositiven Nabelschnurblut-alloHSZT-Empfängern, die eine LetermovirProphylaxe im Vergleich zu einer prä-Letermovir historischen Kontrolle erhielten. [26] Die Ergebnisse zeigten, dass in der historischen Kontrollkohorte bei 82% der Patienten eine klinisch signifikante CMVInfektion beobachtet wurde. Im Vergleich dazu gab es keine Patienten mit Letermovir-Prophylaxe (0%), die eine klinisch signifikante CMV-Infektion am Tag +100 entwickelten (p<0,001 vs. Kontrolle). Drei Patienten hatten eine kurze CMV-Virämie auf niedrigem Niveau, die sich spontan ohne Therapie auflöste. Es wurden keine Letermovir-bedingten Toxizitäten beobachtet.
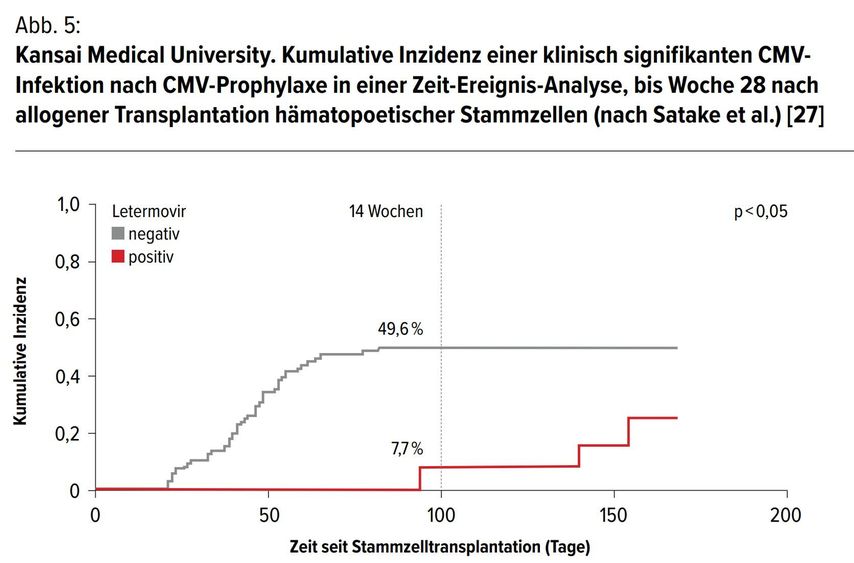
RWE Japan – Kansai Medical University, Osaka
Diese retrospektive Studie (2009–2018) untersuchte die Wirksamkeit und Sicherheit der CMV-Prophylaxe mit Letermovir bei erwachsenen allo-HSZT-Empfängern im Vergleich zu einer historischen Kontrolle. [27]
Die Ergebnisse zeigten, dass in einer Zeit-Ereignis-Analyse die kumulative Inzidenz einer klinisch signifikanten CMVInfektion in der Letermovir-ProphylaxeGruppe niedriger war als in der Nicht-Letermovir-Prophylaxe-Gruppe (7,7% vs. 49,6%; p<0,05) in Woche 14 nach der Transplantation.
Zusammengenommen sind diese RWEDaten aus den USA, Europa und Japan besonders bedeutsam, da sie einstimmig die Vorteile von Letermovir aufzeigen und die Daten der initialen P001-Studie bestätigen. Alle RWE-Studien zeigten, dass deutlich weniger Patienten, die Letermovir erhalten hatten, in den ersten 100 Tagen nach alloHSZT eine klinisch signifikante CMV-Infektion entwickelten. Die Prävention einer CMV-Infektion in diesem Zeitraum ist besonders wichtig, da die Patienten am stärksten immunsupprimiert und damit am anfälligsten für CMV-Infektionen sind. Da die CMV-Reaktivierung nach Nabelschnurblut-HSZT mit einer erhöhten Rekurrenz-Sterblichkeit in Verbindung gebracht wurde, war es bemerkenswert, dass eine klinisch signifikante CMV-Infektion (csCMVi) bei keinem der NabelschnurblutHSZT-Patienten, die Letermovir erhielten, auftrat. [25] Zwei Studien mit TCD, von der bekannt ist, mit hohen csCMVi-Raten assoziiert zu sein, zeigten, dass Patienten, die Letermovir erhielten, signifikant niedrigere Raten von csCMVi hatten. [24, 25]Zwei Studien erbrachten Mortalitätsdaten, die i) eine numerisch niedrigere Gesamtmortalitätsrate bei Tag 100 bei Patienten zeigten, die Letermovir erhielten, und ii) keine CMV-zurechenbaren Todesfälle in der Studie mit einer Gesamtsterblichkeitsrate von 11,3% bei einem Median von 117 Tagen Nachbeobachtungszeit. [23, 25]
Europäische Richtlinien von Expertengremien
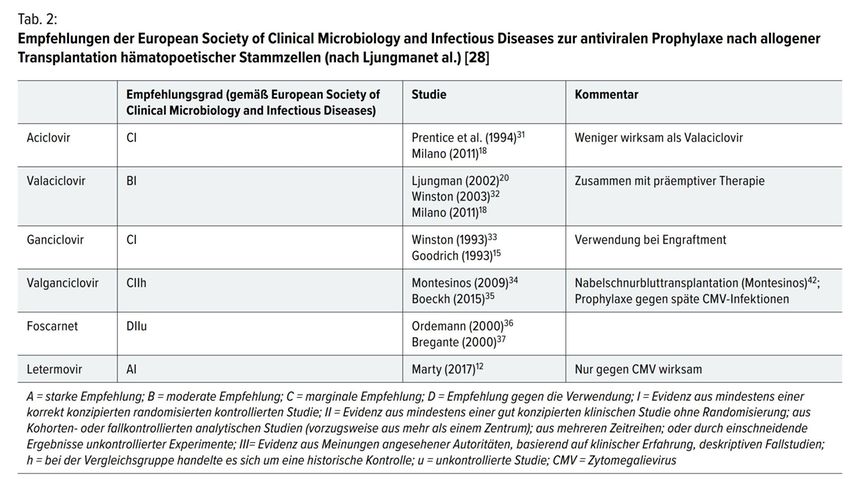
Aktualisierte Richtlinien zur Diagnose und Therapie von Infektionen bei Leukämie (ECIL 7) wurden kürzlich in „Lancet Infectious Diseases“ [28•] veröffentlicht. Letermovir war das einzige Medikament, das mit dem höchsten Empfehlungsgrad für die antivirale Prophylaxe bei allo-HSZT empfohlen wurde.
In den Richtlinien wird explizit festgehalten: „CMV replication itself has been associated with increased non-relapse mortality in patients who have undergone allogeneic HSCT. [29, 30] Therefore, prevention of CMV replication by systemic prophylaxis would be logical.“ [28•]
Zusammenfassung der in diesem med·Diplom vermittelten Lerninhalte
Die CMV-Infektion stellt nach wie vor eine schwerwiegende Komplikation nach allo-HSZT dar und ist mit erhöhter Gesamtmortalität und NRM assoziiert. Empfänger von Nabelschnurblut, haploidenten Transplantaten, Stammzellen von HLA-mismatch unverwandten Spendern und Gaben von ATG haben ein hohes Risiko, nach allo-HSZT an einer CMV-Infektion zu erkranken. Wirksame prophylaktische antivirale Maßnahmen wie Letermovir zusammen mit optimiertem Monitoring und regelmäßige Beurteilung der CMV-spezifischen zellulären Immunität sowie gegebenenfalls der Einsatz der adoptiven T-Zell-Therapie stellen Möglichkeiten dar, die Mortalität nach allo-HSZT künftig zu reduzieren.
Klinische Relevanz:
CMV-Infektionen nach allogener hämatopoetischer Stammzelltransplantation sind mit einer schlechteren Prognose verbunden. Risikofaktoren für das Auftreten von CMV-Infektionen sind vielfältig und die Patienten sollten in den ersten 3 Monaten mittels PCR in Hinblick auf eine CMV-Replikation untersucht werden. Bei der Selektion einer antiviralen Therapie bzw. Prophylaxe sollten die individuelle Situation, das Nebenwirkungsprofil und mögliche Resistenzen berücksichtigt werden.
Das sollten Sie lesen:
Der Autor empfiehlt folgende Referenzen als wissenschaftlich und/oder praktisch besonders relevant (im Text und in der Literaturliste markiert mit •).
[16•] Yahav D et al.: Antiviral prophylaxis in haematological patients: systematic review and meta-analysis. Eur J Cancer 2009; 45(18): 3131-48
Der systematische Review von Yahav et al. untersuchte die unterschiedlichen prophylaktischen CMV-Therapien, u. a. hinsichtlich der Gesamtsterblichkeit.
[28•] Ljungman P et al.: Guidelines for the management of cytomegalovirus infection in patients with haematological malignancies and after stem cell transplantation from the 2017 European Conference on Infections in Leukaemia (ECIL 7). Lancet Infect Dis 2019; 19(8): e260-e72
Diese durch die European Conference on Infections in Leukaemia 2017 (ECIL 7) festgelegten Guidelines stellen den derzeitigen Behandlungsstandard der Therapie und Prophylaxe von CMV-Infektionen nach Stammzelltransplantationen dar
Literatur
[1] Lachmann R et al.: Cytomegalovirus (CMV) seroprevalence in the adult population of Germany. PLoS One 2018; 13(7): e0200267 [2] Hiwarkar P et al.: Frequent occurrence of cytomegalovirus retinitis during immune reconstitution warrants regular ophthalmic screening in high-risk pediatric allogeneic hematopoietic stem cell transplant recipients. Clin Infect Dis 2014; 58(12): 1700-6 [3] Piiparinen H et al.: Comparison of two quantitative CMV PCR tests, Cobas Amplicor CMV Monitor and TaqMan assay, and pp65-antigenemia assay in the determination of viral loads from peripheral blood of organ transplant patients. J Clin Virol 2004; 30(3): 258-66 [4] Poirier-Toulemonde AS et al.: Clinical relevance of direct quantification of pp65 antigenemia using flow cytometry in solid organ and stem cell transplant recipients. J Clin Microbiol 2000; 38(9): 3143-9 [5] Michel Det al.: The UL97 gene product of human cytomegalovirus is an early-late protein with a nuclear localization but is not a nucleoside kinase. J Virol 1996; 70(9): 6340-6 [6] Michel D et al.: Functional regions of the human cytomegalovirus protein pUL97 involved in nuclear localization and phosphorylation of ganciclovir and pUL97 itself. J Gen Virol 1998; 79 (Pt 9): 2105-12 [7] Biron KK: Antiviral drugs for cytomegalovirus diseases. Antiviral Res 2006; 71(2-3): 154-63 [8] De Clercq E et al.: Antiviral activity of phosphonylmethoxyalkyl derivatives of purine and pyrimidines. Antiviral Res 1987; 8(5-6): 261-72 [9] Griffiths PD, Emery VC: Taming the transplantation troll by targeting terminase. N Engl J Med 2014; 370(19): 1844-6 [10] Kaul DR et al.: First report of successful treatment of multidrug-resistant cytomegalovirus disease with the novel anti-CMV compound AIC246. Am J Transplant 2011; 11(5): 1079-84 [11] Chemaly RF et al.: Letermovir for cytomegalovirus prophylaxis in hematopoietic-cell transplantation. N Engl J Med 2014; 370(19): 1781-9 [12] Marty FM et al.: Letermovir Prophylaxis for Cytomegalovirus in Hematopoietic-Cell Transplantation. N Engl J Med 2017; 377(25): 2433-44 [13] Stoelben S et al.: Preemptive treatment of Cytomegalovirus infection in kidney transplant recipients with letermovir: results of a phase 2a study. Transpl Int 2014; 27(1): 77-86 [14] Baldanti F et al.: Emergence of multiple drug-resistant human cytomegalovirus variants in 2 patients with human immunodeficiency virus infection unresponsive to highly active antiretroviral therapy. Clin Infect Dis 2002; 34(8): 1146-9 [15] Goodrich JM et al.: Ganciclovir prophylaxis to prevent cytomegalovirus disease after allogeneic marrow transplant. Ann Intern Med 1993; 118(3): 173-8 [16•] Yahav D et al.: Antiviral prophylaxis in haematological patients: systematic review and meta-analysis. Eur J Cancer 2009; 45(18): 3131-48 [17] Salzberger B et al.: Neutropenia in allogeneic marrow transplant recipients receiving ganciclovir for prevention of cytomegalovirus disease: risk factors and outcome. Blood 1997; 90(6): 2502-8 [18] Milano F et al.: Intensive strategy to prevent CMV disease in seropositive umbilical cord blood transplant recipients. Blood 2011; 118(20): 5689-96 [19] Shereck EB et al.: A pilot phase II study of alternate day ganciclovir and foscarnet in preventing cytomegalovirus (CMV) infections in at-risk pediatric and adolescent allogeneic stem cell transplant recipients. Pediatr Blood Cancer 2007; 49(3): 306-12 [20] Ljungman P et al.: Randomized study of valacyclovir as prophylaxis against cytomegalovirus reactivation in recipients of allogeneic bone marrow transplants. Blood 2002; 99(8): 3050-6 [21] Nakamura R et al.: High-dose acyclovir and pre-emptive ganciclovir to prevent cytomegalovirus disease in myeloablative and non-myeloablative allogeneic stem cell transplantation. Bone Marrow Transplant 2002; 30(4): 235-42 [22] El Haddad L et al.: Clinical and economic burden of pre-emptive therapy of cytomegalovirus infection in hospitalized allogeneic hematopoietic cell transplant recipients. J Med Virol 2020; 92(1): 86-95 [23] Foolad F et al.: Letermovir for the prevention of cytomegalovirus infection in adult cytomegalovirus-seropositive hematopoietic stem cell transplant recipients. Expert Rev Clin Pharmacol 2018; 11(10): 931-41 [24] Brown M et al.: Impact of alemtuzumab dosing and lowdose total body irradiation on cytomegalovirus infection in allogeneic hematopoietic stem cell transplantation. Leuk Lymphoma 2020; 61(12): 3024-26 [25] Lin A et al.: Letermovir for primary and secondary cytomegalovirus prevention in allogeneic hematopoietic cell transplant recipients: real-world experience. Transpl Infect Dis 2019; 21(6): e13187 [26] Lau C et al.: Letermovir prophylaxis demonstrates high efficacy in adult cytomegalovirus (CMV) seropositive cord blood transplant (CBT) recipients: a comparison with pre-letermovir Era CBT controls. Biol Blood Marrow Transplant 2019; 25(3): 94-5 [27] Satake AS et al.: Efficacy of CMV prophylaxis with letermovir early after transplantation. EBMT Meeting 2019; Abstr. #B244 [28 •] Ljungman et al.: Guidelines for the management of cytomegalovirus infection in patients with haematological malignancies and after stem cell transplantation from the 2017 European Conference on Infections in Leukaemia (ECIL 7). Lancet Infect Dis 2019; 19(8): e260-e72 [29] Teira P et al.: Early cytomegalovirus reactivation remains associated with increased transplant-related mortality in the current era: a CIBMTR analysis. Blood 2016; 127: 2427-38 [30] Green JS et al.: Mixed vs full donor engraftment early after hematopoietic cell transplant: Impact on incidence and control of cytomegalovirus infection. Transpl Infect Dis 2019; 21(3): e13070 [31] Prentice HG et al.: Impact of long-term acyclovir on cytomegalovirus infection and survival after allogeneic bone marrow transplantation. European Acyclovir for CMV Prophylaxis Study Group. Lancet 1994; 343(8900): 749-53 [32] Winston DJ et al.: Randomized comparison of oral valacyclovir and intravenous ganciclovir for prevention of cytomegalovirus disease after allogeneic bone marrow transplantation. Clin Infect Dis 2003; 36(6): 749-5 [33] Winston DJ et al.: Ganciclovir prophylaxis of cytomegalovirus infection and disease in allogeneic bone marrow transplant recipients. Results of a placebo-controlled, double-blind trial. Ann Intern Med 1993; 118(3): 179-84 [34] Montesinos P et al.: Incidence, risk factors, and outcome of cytomegalovirus infection and disease in patients receiving prophylaxis with oral valganciclovir or intravenous ganciclovir after umbilical cord blood transplantation. Biol Blood Marrow Transplant 2009; 15(6): 730-40 [35] Boeckh M et al.: Valganciclovir for the prevention of complications of late cytomegalovirus infection after allogeneic hematopoietic cell transplantation: a randomized trial. Ann Intern Med 2015; 162(1): 1-10 [36] Ordemann R et al.: Foscarnet--an alternative for cytomegalovirus prophylaxis after allogeneic stem cell transplantation? Ann Hematol 2000; 79(8):4 32-6 [37] Bregante S et al.: Foscarnet prophylaxis of cytomegalovirus infections in patients undergoing allogeneic bone marrow transplantation (BMT): a dose-finding study. Bone Marrow Transplant 2000; 26(1): 23-9