Nach der Lektüre dieses DFP-Literaturstudiums sind Sie über die derzeit gültigen S2k-Empfehlungen der deutschen und österreichischen Fachgruppen und die GINA-Empfehlungen 2020 zur Asthma-Therapie Erwachsener informiert, können die Differenzen zwischen beiden Leitlinien erkennen und haben Vergleichsmöglichkeiten zur maximalen Dosisempfehlung der inhalativen Kortikosteroide sowie eine Auflistung der derzeit in Österreich verfügbaren Biologika inkl. ihrer Eigenschaften. Weiters sind Sie informiert über die Bestimmungen der NADA (Nationale Antidopingagentur Österreich) bezüglich der Auswirkungen der Therapieänderungen auf Leistungssportler.
Primäre Zielgruppen: Pneumologinnen und Pneumologen, Fachärztinnen und -ärzte für innere Krankheiten, Schwerpunkt Lunge
An Asthma bronchiale, definiert als eine heterogene, multifaktorielle, meist chronisch-entzündlich ablaufende Erkrankung der Atemwege, leiden weltweit rund 358 Millionen Menschen. Wenn auch in den letzten Jahren der Anstieg der Asthma-Prävalenz in den westlichen Ländern zum Stillstand zu kommen schien [1], so steigt die Zahl der Asthmatiker in Afrika, Lateinamerika, Osteuropa und Asien kontinuierlich an. [2]
Sowohl in Deutschland als auch in Österreich ist Asthma eine der häufigsten chronischen Erkrankungen. In Österreich sind schätzungsweise 5% der Erwachsenen und 10% der Kinder und Jugendlichen davon betroffen. [3]
Neue Therapieansätze entwickelt
Wurde vor einigen Jahren als Ursache noch eine isolierte Krankheitsentität auf Basis einer entzündlich bedingten Hyperreaktivität der Bronchien angenommen, so gilt es heute als erwiesen, dass Asthma als Syndrom mit vielen klinischen Phänotypen angesehen werden muss. Weltweite, intensive Forschungen konnten einen Teil der komplexen biologischen Pathomechanismen erkennen und als „Endotypen“ definieren. Dies ermöglichte auch die Entwicklung völlig neuer Therapieansätze.
Eine Reihe von klinischen Studien innerhalb der letzten Jahre bestätigte die Notwendigkeit, bisherige internationale und nationale Therapieempfehlungen zu überdenken. 2017 wurde für Deutschland und Österreich die letzte S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit Asthma [1] und 2018 die Nationale VersorgungsLeitlinie Asthma für Deutschland [4] publiziert, deren Empfehlungen von den internationalen GINA-Guidelines der letzten beiden Jahre divergieren. Da beide Empfehlungen noch aktuell sind, kommt es immer wieder zu Unsicherheiten bzw. zu Verwirrungen in der Therapieplanung.
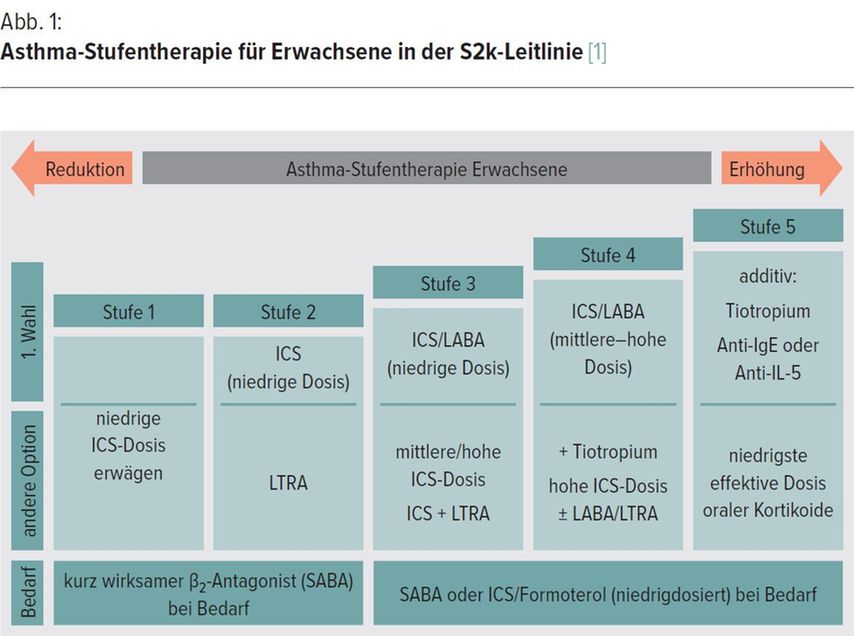
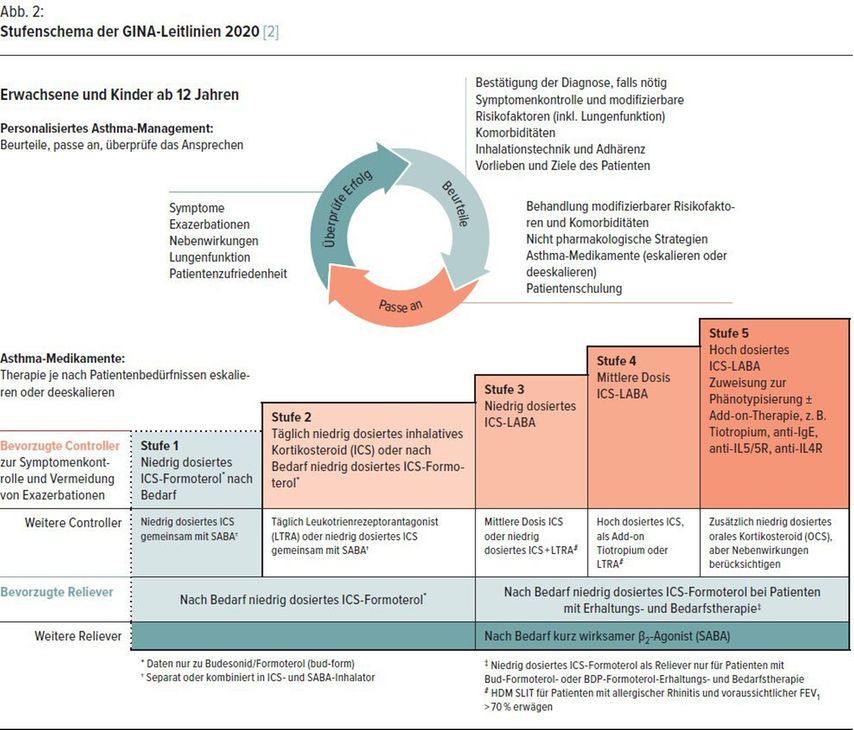
Durch Gegenüberstellung der Asthma-Stufenpläne für Erwachsene sollen die Unterschiede aufgezeigt und auf Besonderheiten im Einsatz von Antiasthmatika hingewiesen werden, welche in der Praxis auftreten (Abb. 1 und 2).
S2k-Leitlinie und GINA-Guidelines gegenübergestellt
Die Einteilung des Asthma-Schweregrades in 5 Stufen hat in beiden Therapieempfehlungen weiterhin Gültigkeit, Differenzen ergeben sich jedoch in der Behandlung in den Stufen 1 und 2, welche doch 50 bis 75% aller Asthmatiker betreffen. [5]
Die GINA-Leitlinien empfehlen seit 2019 in allen Behandlungsstufen eine antiinflammatorische Therapie. Die S2k-Leitlinien empfehlen in Stufe 1 und 2 als Bedarfstherapie („Reliever“) die Inhalation eines SABA. Klinische Studien der letzten Jahre zeigten jedoch, dass die alleinige Inhalation von SABA verglichen mit dem LABA Formoterol und niedrig dosiertem ICS zu signifikant schlechteren Ergebnissen führte. Die Monotherapie mit SABA kann zwar kurzfristig die Asthma-Symptomatik reduzieren, hat jedoch keinen Einfluss auf die zugrunde liegende Inflammation. Daher schützt diese Bedarfstherapie nicht vor schweren Exazerbationen, welche auch in Stufe 1 auftreten können. Es ist bekannt, dass die alleinige Inhalation von SABA zu einer Herabregulation der Beta-Rezeptoren und damit zu einem merkbaren Wirkungsverlust führt. [6] Werden mehr als 3 OP SABA/Jahr als Bedarfsmedikament benötigt, erhöht sich das Risiko für schwere Exazerbationen signifikant, bei einem Bedarf von über 12 OP SABA/Jahr auch das Mortalitätsrisiko. [7] Dusser et al. stellten schon 2007 in einem Review fest, dass 15 bis 20% der Patienten, die an Asthma starben, an „mildem“ Asthma litten. [5] GINA bewertet das Asthma-bezogene Mortalitätsrisiko bei Verwendung einer SABA-Monotherapie mit Evidenz A trotz guter Symptomenkontrolle. [2]
Überlegen Sie:
Wie viele Patienten mit Asthma entsprechend den Stadien 1 und 2 betreuen Sie und welche Bedarfstherapie empfehlen Sie?
In der Literatur werden 50 bis 75% aller Asthmatiker in der Stufe 1 und 2 geschätzt. Als Bedarfstherapie wird ab den GINA-Leitlinien 2019 ICS-LABA empfohlen.
GINA: ICS schon in Stufe 1 empfohlen
Die Autoren des GINA-Reports 2019 führten einen radikalen Kurswechsel zur Behandlung der Stufe 1 durch, indem sie den möglichst frühzeitigen Einsatz inhalativer Steroide postulierten. [8] Die bedarfsmäßige Inhalation einer Fixkombination von ICS/LABA mit Budesonid/Formoterol konnte die Exazerbationsrate auch bei mildem Asthma reduzieren. [9, 10] Diese Daten wurde in einer Real-Life-Studie an 675 Patienten über einen Zeitraum von 1 Jahr bestätigt. Die Exazerbationsrate war in der SABA-Gruppe doppelt so hoch wie in der Budesonid/Formoterol-Bedarfsgruppe. [11] Andere Präparatkombinationen sind nach GINA als „off-label“ zu betrachten.
Die kombinierte Inhalation eines LABA und eines ICS in einem Inhalator als
„(S)MART-Konzept“ ([Single] Maintenance and Reliever Therapy) sowohl als Bedarfsmedikament in Stufe 1 als auch zur regelmäßig verwendeten Basistherapie ab Stufe 2 erleichtert das Therapiemanagement, führt zu rascherer Symptomenkontrolle, reduziert die bronchiale Hyperreaktivität und damit das Exazerbationsrisiko und verbessert die Patienten-Compliance. Wantke zeigt in einem Literaturstudium zum Asthma bronchiale übersichtlich die Möglichkeiten der in Österreich zugelassenen inhalativen Therapeutika auf. [12••]
Die SABA-Monotherapie hat keinen Einfluss auf die zugrunde liegende Atemwegsentzündung und wird nach GINA nur mehr als alternative Bedarfsmedikation empfohlen, wenn Kontraindikationen zur ICS-Inhalation oder eine strikte Steroidabneigung seitens des Patienten trotz umfangreicher Aufklärung vorliegen.
Therapieeinschränkungen liegen bei Leistungssportlern vor. Die Verwendung inhalativer Kortikosteroide ist gemäß den Vorschriften der NADA Österreich erlaubt, als LABA dürfen nur Formoterol und Salmeterol und als SABA Salbutamol ohne medizinische Ausnahmegenehmigung (sog. TUE) verabreicht werden. Jedoch sind Dosisbeschränkungen zu beachten. Werden diese Grenzwerte überschritten, muss der Sportler nachweisen, dass diese trotz Einhaltung der medizinisch empfohlenen maximalen Dosierung überschritten wurden. [13]
Einleitung der richtigen Therapie
Welche Medikamentenkombination soll nun ein „Therapie-naiver“ Asthmatiker erhalten? Die adäquate Initialtherapie ergibt sich nach Diagnose eines Asthma bronchiale im Rahmen der Erstuntersuchung aus der Beschwerdesymptomatik, die der Patient anamnestisch beschreibt, und den Ergebnissen der klinischen Untersuchungen (Tab. 1).
Da die Erstdiagnose im Allgemeinen in einer Phase der Exazerbation gestellt wird, sollte diese Therapieoption bis zur Stabilisierung des Asthmas beibehalten werden. Danach erfolgt eine Neubewertung entsprechend den weiterhin bestehenden Symptomen mittels des Asthmakontrolltests (ACT) oder des vereinfachten 4-Fragen-Schemas nach GINA, wobei die S2k-Leitlinien zusätzlich die Parameter FEV1 und Exazerbationshäufigkeit zur Entscheidungsfindung integrieren (Tab. 2). Danach wird die Therapie durch „Step-up“ oder Step-down“ der entsprechenden Asthma-Stufe vom behandelnden Arzt individuell an den Patienten angepasst.


Überlegen Sie: Wonach richten Sie die Ersttherapie ihres Patienten, wenn noch keine Asthma-Behandlung erfolgt ist?
Die Ersttherapie sollte sich an der Häufigkeit der Krankheitssymptome und dem Lungenfunktiontestsergebnis orientieren.
Therapie ab Stufe 2
Als (weniger effektive) Alternativtherapie ab Stufe 2 wird sowohl in den S2k- als auch in den GINA-Leitlinien ein Leukotrienrezeptorantagonist (LTRA) empfohlen, wenn eine ICS-Therapie nicht möglich ist (z.B. aufgrund ausgeprägter lokaler Nebenwirkungen oder bei Patienten, welche die ICS-Therapie ablehnen bzw. eine komorbide allergische Rhinitis aufweisen).
Sowohl bei „exercise-induced bronchoconstriction“ (EIB, Anstrengungsasthma als einzige Asthmasymptomatik) als auch bei „exercise-induced asthma“ (EIA, behandeltes Asthma mit Beschwerden bei körperlicher Belastung) sind LTRA zur Prophylaxe, jedoch nicht als Akuttherapie empfohlen. Vor Einsatz des in Österreich einzig zugelassenen LTRA Montelukast® sind die Patienten aufgrund der FDA-Warnungen im März 2020 bezüglich neuropsychiatrischer Nebenwirkungen nachweislich aufzuklären. [14]
In beiden Leitlinien erfolgt die Therapieanpassung an die jeweiligen Asthmastufen durch Erhöhung der ICS-Tagesdosen. Dabei empfehlen die S2k-Leitlinien die von ERS/ATS vorgeschlagenen maximalen Tages-Gesamtdosen [15], welche sich von jenen von GINA signifikant unterscheiden. Tabelle 3 informiert über die ICS-Konzentrationen bei niedriger, mittlerer und hoher Dosis für Erwachsene, Tabelle 4 zeigt die ICS-Hochdosis-Definition des ERS-ATS-Konsensus bei Erwachsenen auf.
R. Buhl et al. empfehlen in den S2k-Leitlinien, sich an den Grenzwerten der ICS-Hochdosis der ERS/ATS zu orientieren, da sie den zugelassenen Maximaldosierungen besser entsprechen. [1]


Überlegen Sie: Welche Biomarker bestimmen Sie routinemäßig bei Asthmatikern?
Die wichtigsten Biomarker sind Bluteosinophilie und Gesamt-IgE, bei Verdacht auf eine Inhalationsallergie auch der Allergennachweis. FeNO kann unterstützend zur Kontrolle der Typ-2-Entzündung eingesetzt werden.
Allergen-spezifische Immuntherapie
Studien über eine sublinguale Immuntherapie (SLIT) mit einer Hochdosis-Milbentablette bei Patienten mit Hausstaubmilbenallergie, welche als Ursache einer Rhinoconjunctivitis allergica und eines Asthma bronchiale gesichert war, führten bei beiden Erkrankungen zu einem signifikanten Therapieerfolg mit Abnahme des Steroidverbrauchs bei Asthmatikern – sogar bei jenen, welche nur ein teilkontrolliertes Asthma aufwiesen. Zudem konnte die SLIT auch die Anzahl der Asthma-Exazerbationen vermindern [16, 17], sodass diese Therapie sogar als Controller bei Asthma bezeichnet werden kann. Trotz mindestens dreijähriger Tabletteneinnahme fördert sie die Patienten-Compliance, da sie im Gegensatz zur subkutanen Therapie keine regelmäßigen Arztbesuche zur Medikamentenapplikation erfordert. [12••] Daher wurde diese Therapie für Asthmatiker mit einer vorrangigen Hausstaubmilbenallergie 2019 in die GINA-Leitlinien als eine Therapieoption sogar in Stufe 3 und 4 aufgenommen. Ein unkontrolliertes Asthma, wie es in Stufe 5 definiert wird, stellt jedoch weiterhin eine Kontraindikation dar. [18]
Wenn auch die Allergen-spezifische Immuntherapie (AIT) in den dargestellten Asthma-Stufentherapien (Abb. 1 und 2) nicht explizit vermerkt ist, so stellt sie gerade bei allergischem Asthma in den leichteren Stufen eine wichtige Therapieoption dar, ist doch eine inhalative Allergie besonders auf perenniale Allergene in 70% der Fälle der häufigste Auslöser von Asthma [19] und stellt die AIT die einzig vorhandene kausale Therapie dar. Aus diesem Grund sollte sie schon in Stufe 1 und 2 als Therapieoption neben der Allergenkarenz und Pharmakotherapie der oberen Atemwege bei IgE-vermitteltem allergischem Asthma Anwendung finden. [1]
Die Therapieausweitung in Stufe 4 ist bei Patienten mit ungenügender Asthma-Kontrolle durch einen weiteren Controller in Form von Tiotropium Respimat in beiden Leitlinien unumstritten. Diese Therapieerweiterung stellt jedoch nach Buhl et al. keine obligatorische Voraussetzung für eine Biologikatherapie dar. [1] Die Praktikabilität und Kostenwahrheit rechtfertigen dennoch einen Therapieversuch. Der Einsatz von Chromonen (Nedocromil, Cromoglicinsäure) und Theophyllin sollte mangels Wirksamkeit nur in begründeten Ausnahmefällen als Add-on-Therapie erwogen werden. [1, 2]
Wann sind Biologika indiziert?
Gelingt es bei Personen nicht, das Asthma trotz hoch dosiertem ICS in Kombination mit LABA und Tiotropium wie auch ggf. einem LTRA zu stabilisieren, ist entsprechend den Leitlinien in der Stufe 5 der Einsatz von Biologika (monoklonale Antikörper gegen spezifische Entzündungsmediatoren) zu überlegen. Zuvor jedoch gilt es, durch erfahrene Asthma-Spezialisten festzustellen, ob nicht ein schwieriges Asthma („difficult to treat asthma“) vorliegt, indem sämtliche Optimierungsmöglichkeiten im Asthma-Management ausgeschöpft, Begleiterkrankungen und Komplikationen behandelt sowie persistierende Allergenbelastungen beseitigt und Differenzialdiagnosen ausgeschlossen werden. Nur rund 5% der Asthmatiker zählen zum Formenkreis des schweren Asthmas. [12••]
Die Evaluierung des Phänotyps als Grundlage zur Anwendung der Biologika sollte zur Ausschöpfung individueller Therapieoptionen (z.B. Allergenprävention, AIT, Gewichtsabnahme, AAS/NSAR-Vermeidung etc.) jedoch schon möglichst frühzeitig im Krankheitsverlauf erfolgen. Eine OCS-Dauertherapie ist ohne vorherige Prüfung des Einsatzes von Biologika aufgrund der erheblichen Nebenwirkungen systemischer Kortikosteroide und der teilweise erheblich besseren Wirksamkeit der Biologika zu vermeiden. [20] Tabelle 5 stellt die derzeit in Österreich verfügbaren Biologika,deren Indikationen, Reaktionen und Auswirkungen im Entzündungsprozess und deren Verabreichungsmodalitäten gegenüber.
Die Bestimmung von Biomarkern ist zur Phänotypisierung essenziell, jedoch nur für das Typ-2-assoziierte Asthma (allergisches versus eosinophiles, nicht allergisches Asthma) in Form von Bluteosinophilen, Gesamt-IgE, Allergennachweis und FeNO verfügbar. Diese sollten zumindest 2-mal in exazerbationsfreien Intervallen bestimmt werden. [1] Obwohl alle Biologika in den Entzündungsprozess eingreifen, haben sie unterschiedliche Auswirkungen auf die Biomarker (Abb. 3).
Die Bluteosinophilie ist ein überlegener Biomarker, da hohe Werte mit häufigeren und schwereren Exazerbationen einhergehen. Patienten mit höheren Eosinophilenspiegeln (z.B. ≥300/μl) reagieren meist auch besser auf die monoklonalen Antikörper. [24] Unter OCS-Therapie sinken im Allgemeinen die Eosinophilen, sodass eine Therapieindikation mit Biologika schon ab 150/μl akzeptiert wird. [33••]
Monoklonale AK gegen IL-5/IL-5R sind speziell für Patienten mit adultem eosinophilem Asthma ohne Hinweis auf Atopie oder allergische Genese entwickelt. Häufig besteht auch eine chronische Sinusitis oder Polyposis nasi.
Erst frühestens 4 Wochen nach Beginn der Biologikatherapie sollte die bisherige inhalative und orale Asthma-Therapie unter engmaschiger Kontrolle reduziert werden. [1] Werkzeuge, mit denen das Ansprechen der Biologika evaluiert werden kann, sind der Asthma-Kontrolltest (ACT), der Asthma-Kontrollfragebogen (ACQ), Exazerbationsraten, Wiederherstellung des Geruchssinns sowie Änderung der klinischen Parameter.
Da ein Therapieerfolg nicht selten verzögert eintritt, sollte die Therapie mindestens 4 Monate beibehalten werden, bevor deren Effekt erstmals beurteilt wird. Bei vollständiger Asthma-Kontrolle ohne OCS-Bedarf sollte die Antikörpertherapie weitergeführt werden, bei teilkontrolliertem Asthma zumindest noch weitere 8 Monate, bevor eine Umstellung überlegt wird. Bei Non-Respondern sollte nach 4 Monaten der Initialtherapie ein Wechsel des Biologikums in Betracht gezogen werden. [24] GINA empfiehlt bei allen Asthmatikern mit Biologikatherapie alle 3 bis 6 Monate eine Reevaluierung der Asthma-Kontrolle. [2]
Eine Dauertherapie mit möglichst niedrig dosiertem OCS sollte nur in Fällen durchgeführt werden, bei denen der Biologikaeinsatz nicht möglich ist oder kein befriedigendes Ergebnis bringt. Da jedoch auch Überlappungen von Phänotypen vorkommen, ist ein Wechsel des Biologikums in Betracht zu ziehen. Zu Kombinationen von Biologika gibt es bislang keine validen Daten. [20]
Für nicht Typ-2-assoziiertes Asthma („T2-low asthma“) existieren derzeit bis auf das Differenzialblutbild keine praktikablen Biomarker. Genaue Prävalenzzahlen für diese ebenfalls heterogene Gruppe, zu der das neutrophile Asthma, das Adipositas-assoziierte Asthma der Erwachsenen und das paucigranulozytäre Asthma zählen, sind nicht bekannt.
Allen gemeinsam ist jedoch deren relativ schlechtes Ansprechen auf OCS und die derzeit vorhandenen monoklonalen Antikörper. Daher sollte die Asthma-Diagnose kritisch überprüft werden. [33••] Biologika für diese Asthma-Gruppe sind in Entwicklung.


Überlegen Sie: Nach welchen Kriterien wählen Sie ein Biologikum zur Asthma-Therapie aus?
Entscheidend sind die Krankheitskontrolle in Stufe 5 nach Optimierung des Asthma-Managements, der Phänotyp des Asthmas, Biomarker, evtl. Begleiterkrankungen (chron. Urtikaria, atopische Dermatitis, Polyposis nasi etc.), Möglichkeit der Medikamentenverabreichung (s.c., i.v., monatlich, 2-monatlich).
Zusammenfassung der in diesem med·Diplom vermittelten Lerninhalte
Für die Therapie des Asthmas bei Erwachsenen haben sich in Österreich die deutsch-österreichische S2k-Leitlinie und die GINA-Leitlinie durchgesetzt, deren letzte Updates (2017 bzw. 2020) sich jedoch in der Behandlung des leichten Asthmas unterscheiden. Eine Reihe internationaler Studien der letzten Jahre bestätigte die Überlegenheit der Kombinationstherapie von inhalativen Steroiden (ICS) und lang wirksamen Betaadrenergika (LABA) gegenüber der Monotherapie mit kurz wirksamen Betaadrenergika (SABA). Dies hat auch Auswirkungen bei den Dopingbestimmungen der Leistungssportler.
Die Asthma-Stufen orientieren sich vorrangig an der Beschwerdesymptomatik, der Exazerbationshäufigkeit und an der Verwendung von Bedarfsmedikamenten. Es gibt Unterschiede in den Leitlinien bezüglich der empfohlenen ICS-Maximaldosen. Die Allergen-spezifische Immuntherapie hat in das Asthma-Stufenschema Eingang gefunden und trägt bei Hausstaubmilbenallergikern dazu bei, das Asthma zu stabilisieren. Neue Biologika bieten völlig neue Therapieansätze beim schweren Asthma und ermöglichen eine Einsparung von oralen Steroiden, erfordern jedoch eine genaue Phänotypisierung des Asthmas.
Klinische Relevanz
Die Asthma-Stufenschemata geben allgemeine Therapieempfehlungen, die sich an den Asthma-Schweregraden orientieren. Durch Patientenfragebögen und Biomarker kann der Therapieerfolg beurteilt werden. Die Gegenüberstellung der derzeit in Österreich zugelassenen Biologika in Tabelle 5 gibt Aufschluss über deren Wirkmechanismus, die ausgelösten Reaktionen und die klinischen Voraussetzungen zu deren Verabreichung. Dabei helfen Biomarker, die Effektivität der Antikörpertherapie zu beurteilen.
Das sollten Sie lesen:
Der Autor empfiehlt folgende Referenzen als wissenschaftlich und/oder praktisch besonders relevant (im Text und in der Literaturliste markiert mit **).
[12••] Wantke F et al.: DFP-Literaturstudium Asthma bronchiale – GINA Update 2019.
Beschreibung der Biomarker für Typ-2-Asthma, Auflistung der in Österreich zugelassenen Applikationsformen von Budesonid und Formoterol, Therapieempfehlungen bei Schwangerschaft, Einsatz der Hausstaubmilbentablette als Controller, Eigenschaften der Biologika.
[21••] Timmermann H: Update: Schweres Asthma, CME-Verlag 2019
Überblick über Diagnostik und Therapie in der Asthma-Therapiestufe 5, Differenzialdiagnosen und Komorbiditäten, Beschreibung der Asthma-Phänotypen und der einzelnen Biologika mit Einfluss auf die Biomarker.
[33••] Haasler I, Taube C: T2-Inhibition bei Asthma bronchiale. Allergologie 2019; 6: 275-80
Phänotypisierung, Einfluss der Biologika auf Signalwege der asthmatischen Entzündung, Beschreibung der Biologika, Medikamentenübersicht.
Literatur
[1] Buhl R et al.: S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit Asthma. Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin, Deutsche Atemwegsliga, Pädiatrische Pneumologie und Österreichische Gesellschaft für Pneumologie. Pneumologie 2017; 71: 849-919 [2] GINA-Global Strategy for Asthma Management and prevention (2020 update) www.ginasthma.org [3] Schweres Asthma – oft nicht richtig behandelt? ÖGP-Presseaussendung der Österreichischen Gesellschaft für Pneumologie 2018 [4] Dtsch. Bundesärztekammer, kassenärztliche Bundesvereinigung, AG der Wissenschaftlichen Medizinischen Fachgesellschaften. Nationale VersorgungsLeitlinie Asthma – Langfassung, 3. Auflage, Version 1. 2018. DOI: 10.6101/AZQ/000400 [5] Dusser D et al.: Mild asthma: an expert review on epidemiology, clinical characteristics and treatment recommendations. Allergy 2007; 62(6): 591-604 [6] Hancox RJ et al.: Bronchodilator tolerance and rebound bronchoconstriction during regular inhaled beta-agonist treatment. Respir Med 2000; 94(8): 767-71 [7] Global Initiative for Asthma (GINA). 2019 Pocket Guide for Asthma Management and Prevention [8] Reddel HK et al.: GINA 2019: a fundamental change in asthma management. Eur Respir J 2019; 53: 1901046 [9] Bateman ED et al.: As-needed budesonide- formoterol versus maintenance budesonide in mild asthma. N Engl J Med 2018; 378: 1877- 87 [10] O’Byrne PM et al.: Inhaled combined budesonide- formoterol as needed in mild asthma. N Engl J Med 2018; 378: 1865-76 [11] Beasley R et al: Controlled trial of budesonide-formoterol as needed for mild asthma. N Engl J Med 2019; 380: 2020-30 [12••] Wantke F.: DFP-Literaturstudium Asthma bronchiale – GINA Update 2019. CliniCum pneumo, https://medonline.at/fortbildung/dfp-literaturstudium/ clinicum-pneumo/10038610/gina-update- 2019/ [13] NADA Austria (Nationale Anti-Doping Agentur Österreich) [14] https://www.ifap.de/ arzneimitteltherapiesicherheit/live-ticker-amtsnachrichten/ artikel/article/montelukast-erinnerung- an-neuropsychiatrische-nebenwirkungen//? type=98&print=1&no_cache=1 [15] Chung KF, Wenzel SE, Brozek JL et al.: International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343-73 [16] Virchow JC et al.: Efficacy of a house dust mite sublingual allergen immunotherapy tablet in adults with allergic asthma: a randomized clinical trial. JAMA 2016; 315: 1715-25 [17] Mosbech H et al.: Standardized quality (SQ) house dust mite sublingual immunotherapy tablet (ALK) reduces inhaled corticosteroid use while maintaining asthma control: a randomized, double-blind, placebo-controlled trial. J Allergy Clin Immunol 2014; 134: 568- 75 [18] Pfaar O et al.: Guideline on allergen-specific immunotherapy in IgE-mediated allergic diseases: S2k Guidelines. Allergo J Int 2014; 23: 282-319 [19] Wantke F.: Asthma bronchiale bei Erwachsenen. J Pneumolog 2016; 1: 14-9 [20] Schreiber J, Korn S: Biologika beim schweren Asthma. Welcher Antikörper für wen? Pneumologe 2017; 14: 296-302 [21••] Timmermann H: Update: Schweres Asthma, CME-Verlag 2019, www.cme-kurs.de [22] Humbert M et al.: Benefits of Omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy: INNOVATE. Allergy 2005; 60: 309-16 [23] Gevaert P et al.: Omalizumab is effective in allergic and nonallergic patients with nasal polyps and asthma. J Allergy Clin Immunol 2013; 131: 110-6 [24] Buhl R et al.: Severe eosinophilic asthma: a roadmap to consensus. Eur Respir J 2017; 49: 1700634 [25] Ortega HG et al.: Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014; 371: 1198-207 [26] Bel EH et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med 2014; 371: 1189-97 [27] Gallelli L et al.: Update on anticytokine treatment for asthma. BioMed Research International 2013; 2013: 1-10 [28] Menzella F et al.: Tailored therapy for severe asthma. Multidiscip Respir Med 2015; 10: 1-8 [29] Nowak RM et al.: A randomized trial of benralizumab, an antiinterleukin 5 receptor a monoclonal antibody, after acute asthma. Am J Emerg Med 2014; 33: 14-20 [30] Laviolette M et al.: Effects of benralizumab on airway eosinophils in asthmatic patients with sputum eosinophilia. J Allergy Clin Immunol 2013; 132: 1086-96 [31] Wenzel S et al.: Dupilumab in persistent asthma with elevated eosinophil levels. N Eng J Med 2013; 368: 2455- 66 [32] Vatrella A et al.: Dupilumab: a novel treatment for asthma. J Asthma Allergy 2014; 7: 123-30 [33••] Haasler I, Taube C: T2-Inhibition bei Asthma bronchiale. Allergologie 2019; 6: 275- 80